|
una zeolita es un aluminosilicato (pues están constituidos por Al, Si,
Na y O) cuya estructura es porosa con diámetros de poro
mínimos, o sea de 3 a 10 Å. que forman
cavidades ocupadas por iones grandes y moléculas de agua con gran libertad de
movimiento que permiten el intercambio iónico y la deshidratación reversible, es además altamente cristalino (ya que los grupos de átomos están
dispuestos ordenadamente).
|
|
Por procedimientos clásicos de intercambio que describiremos en el siguiente párrafo se pueden sustituir parte de los iones sodio de las zeolitas faujasitas por cationes de otro tamaño y otra carga. Ésta es una de las características esenciales de todas las zeolitas. En efecto, así se consigue modificar considerablemente sus propiedades y ajustar la zeolita a los usos más diversos.
El intercambio catiónico se puede efectuar de varios modos:
1) Intercambio en contacto con una solución salina acuosa (intercambio hidrotérmico) o con un solvente no acuoso;
2) Intercambio en contacto con una sal fundida. Por ejemplo, una zeolita A, originalmente con calcio, se pone en contacto con nitratos de litio, potasio o rubidio fundidos hacia 350°C;
3) Intercambio en contacto con un compuesto gaseoso. Por ejemplo, una zeolita faujasita Y, originalmente en su forma Na, se pone en contacto con HCl anhidro o NH3, hacia 250°C.
En general, es el intercambio hidrotérmico el procedimiento más utilizado en el caso de las zeolitas. Intercambiemos entonces, según dicho procedimiento, el Na+ de nuestra faujasita por iones (Ca+2). Hay que poner en contacto una cierta cantidad de zeolita faujasita (sodio) con una solución acuosa de una sal de calcio (como el nitrato de calcio).
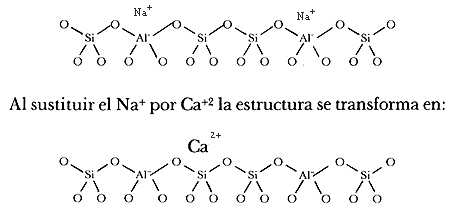
A continuación representamos de modo esquemático la superficie de una zeolita en forma sódica que se intercambia con iones de calcio. Explícitamente se muestran los átomos de silicio (Si), aluminio (Al), oxígeno (O), sodio (Na) y calcio (Ca). Las paredes de los canales que forman la superficie interna están tapizadas de iones de oxígeno. Estos canales contienen un arreglo regular de cationes cuya carga depende de qué tan mala sea la coordinación local o del efecto de pantalla debido a los iones oxígeno de la red. Estos canales contienen un arreglo regular de cationes:
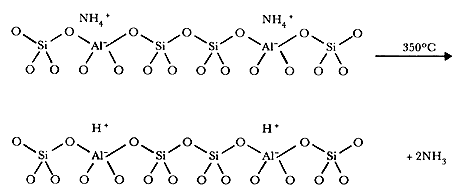
Un caso interesante por sus propiedades ácidas es la obtención de la zeolita Y en su forma hidrógeno. Este material se obtiene remplazando los sodios por moléculas de NH4+ que por calentamiento se descomponen en NH3 y H+:
El intercambio de iones en las zeolitas depende de:
1) La naturaleza de las especies catiónicas, o sea, del catión, de su carga etc.
2) La temperatura.
3) La concentración de las especies catiónicas en solución.
4) Las especies aniónicas asociadas al catión en solución.
5) El solvente (la mayor parte de los intercambios se efectúan en solución acuosa, aunque también algo se hace con solventes orgánicos) y,
6) Las características estructurales de la zeolita en particular.
Es bien sabido que los sitios I son los más difíciles de intercambiar en los prismas hexagonales. El rubidio y el cesio quedan excluidos debido a su tamaño: son demasiado grandes para pasar a través de aberturas cuyo diámetro es de 2.2 Å.
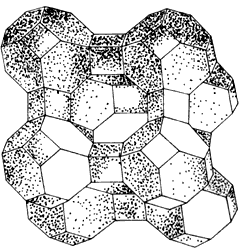
Una aplicación particularmente interesante de intercambio de iones se da en la zeolita A, que se parece mucho a la faujasita, en la que, en vez de unirse las cavidades por canales hexagonales lo hacen por canales cuadrados (Figura 11). La sustitución de cuatro iones de sodio en los sitios tipo II de la estructura de la zeolita A, por dos iones de calcio altera la estructura cristalina de tal forma que permite la difusión rápida de ciertas moléculas de hidrocarburos* e impide el paso de otros.
Claramente, las características de los poros de la zeolita van a ser de primordial importancia. Es más, dada la regularidad de su estructura, es posible aprovecharlas para tamizar moléculas, atrapar compuestos o absorber gases. Con el intercambio iónico es posible alterar el tamaño de los canales por los que circulan las moléculas; también gracias al intercambio iónico se pueden anclar metales con propiedades químicas peculiares en algunas de esas posiciones.
No hay comentarios:
Publicar un comentario